
의학계에서 암을 정복하기 위해 노력하고 있지만, 기대만큼의 성과를 거두진 못하고 있다. 그렇다 보니 현대의학으로 고치지 못하는 말기암환자들은 ‘용하다’는 입소문에 휘둘리기 쉽다. 대부분 과장되거나 사기인 경우가 많다. ‘세계 최초로 개발된 천연물신약 항암제’라는 SB주사 이야기를 처음 들었을 때 신뢰가 가지 않은 건 이 때문이다. 게다가 의사나 약사 면허도 없는 개인이 항암제를 개발했다니….
그런데 세계적인 암 권위자인 김의신 박사가 이 신약을 알리는 데 적극 나섰다. ‘미국 최고 의사’로 11차례나 뽑힌 그는 세계 유수의 암 전문병원 MD앤더슨 암센터(이건희 삼성 회장이 폐암 수술을 받은 병원) 종신교수였다. 현재 캘리포니아 의대 교수, 서울대 융합기술대학원 초청교수, 경희대 석학교수로 있다.
이종화 삼육서울병원 암센터장, 안병준 전 충남대 약학대학장, 홍순선 인하대 의대 교수 등은 이 신약의 효능·효과를 연구한 논문을 대한암학회 학술지와 해외 권위 있는 암 전문 학술지에 꾸준히 게재하고 있다. 논문에 따르면 효능·효과도 뛰어나다. 이 정도면 벌써 세계적으로 주목받아야 한다. 그런데 우리나라에서조차 아직 전면 시판이 안 되고 있다. 무슨 사연이 있는 것일까.
개발자인 김송배(74) 씨는 스무 살 때 코에 생긴 악성종양을 할미꽃뿌리(백두홍)로 고친 것을 계기로 SB항암제를 개발, 의사 김순환 박사와 함께 이 약을 의학적으로 연구하기 시작했다. 그에 따르면 1980년대 중반부터 11년 동안 말기암환자 400여 명을 직접 치료해 80% 가까이 병세가 호전됐고, 10%는 사실상 완치되는 성과가 있었다고 한다.
국제 특허 21개
1989년 김씨는 자신이 개발한 항암제를 국내는 물론 유럽연합, 미국, 일본 등에 특허 신청을 냈다. 국내는 1994년 1월에, 유럽특허청은 같은 해 3월에 의약품 발명특허를 인정했다. 그는 현재 SB주사와 관련해 국내 특허 12개, 국제 특허 21개를 보유하고 있다.김씨는 1990년부터 본격적으로 신약 개발에 나섰다. 1990년 서울대 생약연구소를 시작으로 1997년까지 9개 연구소에서 20개 전(前)임상을 통해 안전성과 유효성을 인정받았다. 이를 근거로 1998년 4월 보건복지부로부터 신약 허가를 받았다. 1998년 12월부터 2003년 5월까지 영남대학병원에서 비소세포폐암 1상 임상시험을 실시했다. 폐암 등 말기암환자 27명을 대상으로 진행한 결과, 약 80%의 환자에게서 더 이상 암이 진행되지 않았다. 상당한 통제 효과가 있다는 의미다.
2002년엔 안병준 충남대 약학대 교수가 신약의 주성분인 할미꽃뿌리에서 핵심물질을 분리하는 데 성공했다. 풀사틸라 사포닌D(Pulsatilla saponinD)가 항암작용을 하며, 디옥시포도필로톡신(deoxypodophyllotoxin)이 신생혈관 생성을 억제해 암세포가 더 이상 자라지 못하게 막는다는 것을 밝혀낸 것. 한국과학기술 한림원 종신회원인 안 교수는 세계 최초로 은행잎에서 약용 엑기스를 추출해 ‘징코민’을 개발한 천연의약 분야의 권위자다.
2003년 희소식이 들려왔다. ‘천연물신약연구개발촉진법’이 발효된 것. 천연물신약은 식물이나 광물 등 천연물질에서 추출한 성분을 원료로 한 의약품을 말한다. 이 법은 ‘식품의약품안전처장은 암, 후천성면역결핍증 등 생명을 위협하는 질병에 사용되는 천연물신약을 연구·개발해 안전성과 효력 및 용법·용량을 입증할 수 있는 자료를 제출받은 경우에는 우선 심사해 해당 질병의 보조제로 시판 후 임상시험 성적에 관한 자료 제출 등의 조건을 붙여 신속하게 허가할 수 있다’고 규정했다. 안전성과 효력 및 용법·용량을 입증할 근거가 있으면 먼저 판매하면서 임상을 진행할 길이 열린 것이다.
임상시험을 하려면 한 번에 수십억 원씩 든다. 우리나라에서 신약 개발이 더딘 이유다. 제품을 판매하면서 그 수익으로 임상시험 비용을 충당할 수 있으면 원천기술만 있는 작은 제약사도 신약 개발이 가능해진다. 그게 이 법을 만든 근본 취지다.
SB주사 제약사는 이 법을 근거로 신약 시판 허가를 요청했지만, 식약처는5년간 받아들이지 않았다. 2007년 국정감사에서 여야 의원들이 ‘원칙과 형평성에 어긋난다’고 질타하자, 지난 5년 동안 ‘안전성은 인정되나…효력 및 용법, 용량에 대한 타당성이 인정되지 않았다’며 시판을 불허하던 태도를 바꿔 2008년 6월 시판 허가를 내준다. 지정된 1곳의 병원에서만 처방할 수 있는 제한 시판이었다. 지정병원도 대형종합병원들의 외면으로 경기도에 있는 샘병원을 겨우 섭외했다.
두 달 만에 태도 바꾼 식약처
제약사는 2상전기 임상시험 결과 등을 근거로 시판 허가를 신청했다. 하지만 2012년 12월 열린 식약처 중앙약사심의위원회에서 부결됐다. ‘임상 수행기관의 신뢰성에 문제가 있으며’, ‘허가하기에는 자료가 많이 부족하다’는 이유였다. 심지어 “(이런 약에) 조건부시판허가가 되었다는 게 놀랍다. 마치 포도당주사를 항암제로 사용하자는 것과 같은 말”이라며 극단적 불신을 표시한 위원도 있었다.
식약처는 위원회 판단을 근거로 제약사에 ‘효과가 검증되지 않았으므로’ 확대를 허가할 수 없다고 통보했다. 김송배 씨가 격렬하게 항의하자 ‘효과가 검증되지 않았다’던 식약처는 두 달 만인 2013년 2월 말을 바꿔 ‘약사법 관련규정에 적합’하다며 제한 시판 병원을 추가로 두 곳(삼육서울병원, 대전둔산한방병원) 더 허용했다.
작은 제약사, 병원이라 불신?
하지만 2015년 5월 열린 중앙약사심의위원회에서 위원들은 ‘(제약사가 제출한) 사용성적 보고 자료는 유효성을 판단할 자료가 아니’라며 불허 결정을 내렸다. 한마디로 병원 3곳에서 제출한 자료는 신뢰할 수 없다는 것이다.
2012년과 2015년 회의록을 입수해 내용을 분석했다. 제출 자료를 제대로 검토하지 않고 왔다는 느낌을 주는 위원들의 발언이 눈에 띄었다. 더구나 위원들이 ‘용법과 용량을 확인하기 어렵다’ ‘효용을 입증하기 어렵다’는 것을 불허 이유로 들었는데, ‘용법·용량’ ‘효용’은 식약처에서 1상 임상과 2상전기 임상을 승인하며 인정한 사안이다. 이를 부정하는 것은 식약처가 자기가 한 결정을 부정하는 자기모순이 된다.
중앙약사심의위원회는 왜 이런 결론을 고수하는 걸까. SB주사를 처방하고 있는 삼육서울병원 암센터장 이종화 박사는 “작은 회사에서 만든 항암제인데다, 작은 병원에서 임상을 했으니 의구심을 가진 모양”이라고 아쉬워했다.
“2015년 회의할 때 증인으로 출석했는데, 이미 결론을 내고 회의를 하는 것 같았다. 그래도 난 대학병원 출신이고, 위원 중에 후배와 제자도 있어 체면치레로 5분 정도 발언하게 했지, 다른 병원에서 온 의사에게는 이야기할 기회도 주지 않았다.”
‘비타민 박사’로 유명한 면역학전문의 이왕재 서울대 의대 교수는 “나도 의사이지만, 의사들의 편견을 있는 그대로 보여준 것”이라며 쓴웃음을 지었다. 그는 “이 신약은 현대 의약품인데도 의사들 중에는 한약인 줄 아는 경우가 많다. 그래서 꺼리는 것”이라고 말했다.
“2상전기 임상 결과를 언뜻 보면 효과가 미진한 것처럼 보일 수 있다. 하지만 보고서를 꼼꼼하게 봤다면 그런 결론을 내릴 수 없다. 임상과 병원 세 곳에서 사용한 실적 모두 말기암환자를 대상으로 처방한 것이다. 말기암환자를 완치하는 건 불가능하다. 다른 항암제에서 효과를 보지 못한 말기암환자가 긍정적인 치료 효과를 보였다는 것 자체가 중요하다. 무엇보다 생명을 연장시켰다는 건 큰 성과다.”
다국적 제약사로 넘어간다면…

신약은 어느 정도 효능과 효과가 있는 것일까. 세계적인 암 학자로 유명한 김의신 교수를 만났다.
“3년 전부터 관심을 갖고 전임상, 임상 1상과 2상전기, 각종 치료 및 연구논문을 검토한 결과 기존 항암제에 비해 거의 부작용이 없다는 걸 알게 됐다. 환자의 혈액검사 결과 간이나 신장 기능에 전혀 지장을 주지 않았고, 혈소판 적혈구 및 백혈구의 감소로 인한 면역 저하 등 혈액학적인 문제도 거의 없었다. 단 1명도 기존 항암제 사용 때 동반되는 심각한 부작용이 없었다. 이것은 암 치료에 가장 중요한 문제다. 또한 탈모, 구토, 식욕부진 같은 증세도 거의 없어 환자의 삶의 질이 높아졌다.”
▼ 항암 효능은 어떤가.
“일반 항암제는 1개 내지 3개 정도 암에 효과를 보이는 데 비해 신약은 췌장암, 복막전이암, 간암, 위암, 대장암, 폐암, 담도암, 흑색종, 혈관육종, 자궁경부암, 갑상선암, 뇌종양, 유방암 등 20여 가지의 암에 상당한 치료 효과가 있다. 특히 말기환자들에게 흔히 나타나는 복수, 흉수 등에도 큰 도움이 된다는 것은 의심할 여지가 없다. 만약 초기 암환자에 적용된다면 부작용 없이 암을 치료하는 혁신적인 세상이 열릴 것으로 본다.
투유유 중국전통의학연구원교수는 개똥쑥을 이용해 말라리아를 퇴치하는 데 기여한 공로로 노벨의학상을 받았다. 중국은 천연물을 이용한 신약 개발로 연간 180억 달러를 벌어들이고 있다. 우리나라도 한미약품이 자체 개발한 신약으로 글로벌 제약사들로부터 8조 원이라는 천문학적 규모의 기술 수출 계약을 체결하며 제약산업의 가능성을 보여줬다. 만약 이 신약 기술이 우리나라에서 제대로 평가받지 못하고 다국적 제약사로 넘어간다면 우리는 앞으로 엄청난 비용을 지불해야 한다.”
천연물 의약품에 대한 불신
이종화 삼육서울병원 암센터장도 신약의 효능에 확신을 갖고 있다. 그는 연세대 의대 교수로 정년퇴임했으며, 용인세브란스병원장, 영동세브란스 혈액내과 과장을 지냈다.“직접 써보니 과거 대학병원에서 쓰던 항암제들보다 나쁘지 않았다. 기존 항암제가 종류도 많고 쓰이는 곳도 다 달라서 일괄적으로 이야기하기는 어렵지만 어떤 면에선 효과가 훨씬 좋다. 직접 써보니까 그렇다.”
▼ 실제 치료 효과는 어떤가.
“그동안 치료한 암환자가 500명이 넘는다. 90% 이상이 암이 전이된 환자, 말기암환자였다. 이들 중에서 췌장암 4기 환자 50명을 대상으로 분석했는데 15개월 이상 생존율이 54%에 달했다. 이 약을 투여하지 않은 대조군 환자 생존율은 10% 내외였다. 이 정도면 큰 효과가 있다고 봐야 한다. 이 연구 결과를 대한암학회지와 미국 암학회지(Cancer Treatment and Research)에도 발표했다.”
▼ 안전성은 어떤가.
“다른 항암제는 독성이 매우 강해 피부에 약물이 닿으면 피부가 괴사할 정도다. 그런데 신약은 서울대에서 쥐와 토끼를 대상으로 연구한 결과 눈에 직접 떨어뜨려도 이상이 없었다. 또한 적정량의 70배까지 과다 투여해도 안전성에 이상 없었다. 이외에도 암 부위에 직접 투여할 수 있어 약효가 더 강하게 작용한다. 정맥 투여 외에도 암 부위에 직접 고농도로 투여할 수 있고, 흉강이나 복강에도 직접 주입할 수 있어 약효가 더 강하게 나타난다.”
▼ 그렇게 좋은데 왜 의사들이 외면할까.
“우리나라 의사들은 세계적으로 검증된, 안전한 제품만 사용하려 한다. 생명을 담보로 하기 때문에 당연히 조심해야 하는 것도 있지만, 괜히 썼다가 문제가 생기면 안 된다는 회피의식도 없다고는 할 수 없다. 천연물 의약품에 대한 불신도 있을 것이다. 외국에서도 아직까지 천연물 항암제는 개발되지 않았다.”
▼ ‘이렇게 좋은 항암제라면 2차후기 임상이 늦어지는 게 이해가 안 된다’고 말하는 중앙약사심의위원회 위원도 있었다.
“실정을 모르고 하는 말이다. 우리 병원만 해도 복막전이암 임상시험을 하고 있는데, 임상 환자 구하기가 힘들다. 큰 병원은 암환자가 많으니까 구하기가 쉽겠지만 우리 병원만 해도 환자 수도 적은 데다, 해당 원발성 암환자를 구하기 어렵다. 큰 병원에서 보내주면 좋겠지만 생각보다 안 보낸다. 자기 환자를 누가 보내려 하겠나.”
말기 췌장암 2명 계속 생존
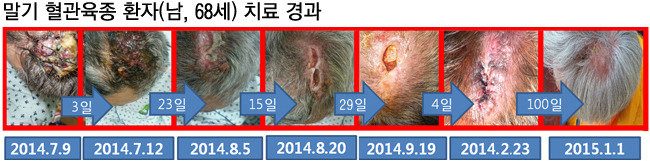
이종화 암센터장은 자신이 치료한 환자들의 치료 경과를 찍은 사진을 보여주었다. 치료 효과가 확실하다고 판단되는 환자가 50명을 훌쩍 넘었다. 두피가 손바닥 크기보다도 더 크게 괴사된 말기혈관육종환자는 치료 174일 만에 암이 대부분 사라지고, 두피에 새살이 돋아 있었다. 복막에 복수가 가득 찼던 환자에게서 복수가 사라진 것은 물론, 유방암이 늑막으로 전이되면서 폐가 옆으로 밀려날 정도로 늑막에 흉수가 찼던 환자도 흉수가 사라졌다.그는 신약이 암 중에서 가장 악성이라는 췌장암에 특히 효과가 있었다고 했다. 86세 여성은 췌장암 말기였음에도 2년 전 치료를 받은 후 지금도 생존해 있으며, 66세 남성 역시 2년 전 췌장암 말기 판정을 받고 이곳에서 치료 받은 후 건강하게 생존해 있다.
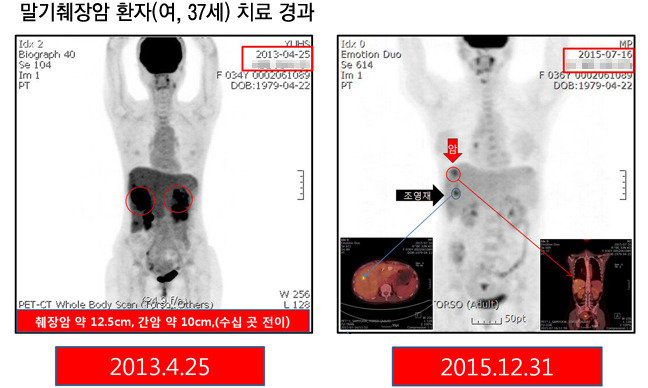
서울의 대형종합병원 간호사였던 일본인 여성(37)은 3년 전, 일하던 병원에서 췌장암 말기 판정을 받았다. 췌장암 크기가 12cm에 달했고, 간에도 10cm 크기 암이 있었다. 뼈에도 전이된 상태였다. 제거수술은 불가능했고, 방사선치료도 효과가 없을 거라 확신한 담당의는 “여생을 잘 정리하라”고 했다.
“길어야 6개월이라는 시한부 판정을 받고 이곳에 온 그는 2년이 훨씬 지난 지금도 잘 살고 있다. 여기 올 당시 바싹 말라 있던 사람이 지금은 살도 통통하게 쪘다. 일상생활을 하는 데 아무 문제없다. 건강한 모습으로 전에 일하던 병원에 가니까 동료들이 깜짝 놀라더라고 웃으며 말하더라. 물론 완치 된 것은 아니다. 암이 99%는 없어졌지만 간 주위에 아주 작은 점들이 보여 계속 관찰 중이다.”(이종화 암센터장)
김의신 교수는 “일본인 여성처럼 췌장암 크기가 12cm가 넘는 환자가 치료에 성공한 사례는 세계적으로도 드문 케이스다. MD앤더슨 암센터에도 내가 근무한 31년 동안 한 번도 없었다. 암 발견이 늦어 다른 항암제를 거의 쓰지 않고 바로 이 신약을 투여해 효과를 본 것이 아닐까 한다”고 추정했다.
▼ 그 정도로 효과가 있으면 입소문이 나 환자가 밀려들지 않나.
“신약이 기존 항암제보다 싼 편이긴 하지만, 의료보험 적용이 안 돼 치료비 부담이 크다. 한번 입원하는 데 400만 원에서 500만 원씩 들어간다. 그걸 3회 이상 해야 한다. 실손보험에 가입한 환자들은 보험금으로 치료비를 충당할 수 있지만, 그렇지 않은 환자들은 의료보험이 적용돼 약값의 5%만 내면 되는 기존 항암제가 경제적 부담이 적어 그걸 선택하게 된다. 결국 건강보험료에서 외국 제약사로 약값을 지불하니 국가재정 부담만 커지는 것이다.”
표준요법 확립돼 불허?

또한 그 이유로 ‘용법·용량 등을 입증할 수 있는 자료(후기 2상 임상시험 자료)가 제출되지 않았으며’ ‘현재 비소세포폐암에 대한 치료제가 10품목 이상 허가되어 있고’ ‘표준요법(관련 분야 전문가들에 의해 질환 치료에 적절한 치료방법으로 인정되어 사용되는 치료방법)이 확립된 점’을 들었다. 자문기구인 중앙약사심의위원회에서도 ‘㈜에스비피가 제출한 자료로는 동규정 43조에 따른 용법·용량 등을 입증하기 어려우므로 특정 병원에 제한 없이 사용하는 것은 바람직하지 않다’고 자문했다고 밝혔다.
식약처는 답변을 통해 ‘의약품은 국민건강에 필수적인 제품으로 시판 허가를 위해서는 객관적인 자료와 전문적 검토를 통해 안전성이 확보되어야 하며 제품 사용의 유익성이 위험성을 상회할 수 있다는 것을 입증할 수 있어야 한다’고 강조했다.
이에 대해 백준흠 대표는 “표준요법이 확립돼 있으면 새로운 개발신약의 시판허가를 제한할 수 있다는 법적 근거가 뭔지 의문”이라며 답답해했다.
“식약처의 ‘의약품 품목허가·신고·심사규정’에 생명을 위협하거나 심각한 질병 치료의 효과를 기대할 수 있는 항암제는 특례 규정을 적용(제58조 신속심사규정)해 조기에 환자사용을 허용해 주도록 하고 있다. 또한 천연물신약개발촉진법에서 천연물·신약연구개발 결과의 산업화를 촉진하기 위해 지원시책을 강구하라고 규정하고 있는데 왜 식약처는 법에서 정한 규정들을 외면하는지 모르겠다.”
뇌종양 전임상 완료
SB주사 제약사는 현재 100억 원이 넘는 적자를 보고 있지만, 개발을 포기하지 않고 다양한 암에 대해 임상을 진행하고 있다. 의사 사회에서도 조금씩 변화의 조짐이 보이고 있다. 이왕재 서울대 의대 교수는 2015년 10월 악성 뇌종양인 교모세포종 2가지 종류에 대한 전임상 시험을 성공적으로 완료했다. 그는 SB주사를 활용한 표적치료제 연구도 병행하고 있다. 이 교수는 세계 최초로 암 부위에 직접 주사하는 방식으로 뇌암 2상 임상시험을 하는 것을 추진하고 있다.췌장암을 전문으로 하는 다른 대형종합병원에서도 신약에 관심을 표하고 있다고 이종화 암센터장은 전했다. 이 외에도 몇몇 병원과 요양병원에서 신약을 사용할 방법을 묻는 전화가 오고 있다고 한다.
죽음을 앞둔 환자를 대상으로 사기를 치는 것만큼 나쁜 일은 없다. 하지만 말기암환자들에게 희망이 될지도 모를 기회를 무조건 박탈하는 것도 아집이나 책임회피일지 모른다. 제약사와 식약처, 중앙약사심의위원회 위원들 모두 열린 자세로 암환자들에게 진정 도움이 되는 방법을 모색해야 하지 않을까 싶다. 보건복지부에서 품목허가(1994.4월)를 한 지 22년이 다 돼간다.
















![[영상] 미친 ‘사과 값’의 나라, 생산지부터 마트까지 ‘사과 길’ 추적하다](https://dimg.donga.com/a/570/380/95/1/carriage/MAGAZINE/images/shindonga_home_top_2023/6621b46f046ed2738276.jpg)






