- 핵이나 원자력 관련 용어는 너무 어렵게 느껴져 무조건 멀리하는 경향이 있다. 그러나 알고 보면 원자력은 그렇게 무서워할 존재가 아니다. 알기 쉽게 설명한 원자력 용어 풀이.
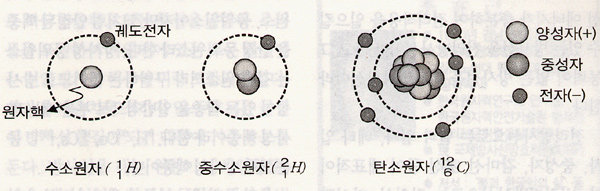
[그림 1] 원자와 원자핵. 원자는 핵과 궤도전자로 구성된다. 핵은 양전기를 띤 양성자와 중성인 중성자로 구성되며 궤도전자는 음전기를 띤 작은 입자이다. 핵의 양성자 수는 물질의 원소 종류를 결정한다. 핵의 양성자 수나 중성자 수가 다른 원자는 서로 다른 핵종이다. 양성자 수는 같으나 중성자 수가 다른 핵종(그림에서 수소와 중수소)은 서로 동위원소 관계에 있다.
원자핵 내에 양성자가 몇 개 있는지에 따라 물질(원소)이 달라진다. 가장 가벼운 경우는 핵이 양성자 하나로만 된 것인데, 이것이 수소 ( 11H)이다. 보통의 산소 원자는 핵에 8개의 양성자와 8개의 중성자를 가진 816O이다. 이 기호에서 영문자 O는 원소의 종류(산소)를 나타내는 원소기호이고 왼편 아래의 첨자 8은 핵 내의 양성자 수를 나타내는 것으로 원자번호라 부르고, 위에 있는 첨자 16은 핵의 양성자 수와 중성자 수를 합한 것으로서 질량수라 부른다.
따라서 어떤 원소인가는 원자번호에 의해 결정되는데 원자번호가 1, 6, 7, 8, 26, 92이면 각각 수소(H), 탄소(C), 질소(N), 산소(O), 철(Fe), 우라늄(U)이 된다. 이것은 불변이므로 종종 원소기호만 적고 아래에 붙는 원자번호는 적지 않는다
물질의 화학적 성질은 원소의 종류에 따라 달라진다. 같은 원소이면 핵의 양성자 수는 같지만 중성자 수가 다를 수 있다. 예를 들면 수소 핵에 중성자는 하나나 둘이 있을 수 있다. 그렇다면 2H, 3H가 된다. 이것은 수소이지만 무게가 무거운 수소로서, 각각 ‘중수소’와 ‘삼중수소(또는 트리튬)’로 부른다. 핵의 양성자 수가 다르거나 중성자 수가 다른 핵을 구분하기 위해 ‘핵종’이란 용어를 사용한다. 1H, `2H, `235U는 각각 다른 핵종이다.
방사선이란?
사람이 열을 받으면 불안정해지듯이, 물질도 내부 에너지가 불필요하게 높아지면 불안정해진다. 불안정한 상태를 안정된 상태로 변화시키려는 것은 자연의 법칙이다.
우리 주변에 있는 핵종을 보면 `612C, `714N, 816O처럼 대체로 핵의 양성자 수와 중성자 수가 같거나 비슷하다. 만일 핵에 양성자에 비해 중성자가 불필요하게 많거나 부족해지면 그 핵은 불안정해지므로 에너지를 내보내려 한다.
1H이나 2H는 안정 상태이지만 3H는 중성자가 많아 불안정하다. 따라서 3H는 에너지를 내보내려는 성질이 있는데 이렇게 내보내는 에너지가 ‘방사선’이다. 방사선이란 에너지의 흐름이다. 방사선의 형태는 입자일 수도 있고 전자파일 수도 있다. 이렇게 방사선을 내보내려는 성질을 ‘방사성’이라 한다.
방사선이 물질에 들어가면 그 물질을 이루는 원자와 작용하여 자신의 에너지를 물질에 전달하는데 이 과정에서 상대 원자를 ?인 이온과 ?인 전자로 분리할 수도 있다. 이 작용을 전리(電離)작용이라 하는데 방사선 에너지가 충분하여 전리작용을 일으킬 수 있는 방사선을 전리방사선이라 하고 그 능력이 없는 방사선을 비전리방사선이라 한다.
전리방사선으로는 알파 입자, 베타 입자, 중성자, 감마선, X선 등이 대표적이다. 비전리방사선으로는 적외선, 가시광선, 자외선, 마이크로웨이브, 단파 등이 있다. 원자력 분야에서 방사선이라고 할 때는 주로 전리방사선을 가리킨다. 반핵단체가 이야기하는 핵방사선도 전리방사선을 의미한다. 알파 입자는 양성자 둘과 중성자 둘이 뭉친 양전기를 띤 입자이며 베타 입자는 전자이다. 감마선과 X선은 모두 전자파이다.
위에서 언급한 1H, `2H, 3H는 다른 핵종이지만 모두 수소이므로 화학 주기율표에서는 같은 위치에 들어간다. 그래서 동위원소라 한다. 동위원소는 화학적으로는 같은 원소이지만 무게가 다른 핵종이다. 3H처럼 동위원소 중에서 방사성인 것을 방사성 동위원소, 동위원소이지만 2H처럼 안정된 핵종을 안정 동위원소라 한다. 방사성 동위원소는 같은 원소끼리 구별하는 것이므로 방사성이 있는 핵종을 일반적으로 부를 때는 방사성 핵종이라 한다. 3H, 60Co, 137Cs, 238U 등은 모두 방사성 핵종이다.
우리 주변에는 인류가 생기기 전부터 천연에 존재해온 방사성 핵종이 있는데 이를 천연 방사성 핵종이라 부르기도 한다. 대표적인 천연 방사성 핵종에는 우라늄과 토륨(Th), 이 핵종들이 붕괴하여 생성되는 226Ra(라듐), 222Rn(라돈), 210Po(폴로늄) 등의 자손핵종, 그리고 40K와 같은 핵종들이 있다.
그 밖에도 태양과 같은 항성(恒星)이 내는 방사선이 지구에 도달하여 핵반응을 일으켜 생성하는 3H, 14C와 같은 천연 방사성 핵종도 있다. 이에 반해 인공적 핵반응으로 발생한 것을 인공 방사성 핵종이라 한다. 하지만 3H, 14C과 같은 핵종은 인공적으로 만들기도 하므로 천연과 인공으로 구분하는 것은 정확하지 않다.
방사성 핵종인 원자들은 불안정하므로 언젠가는 핵변환(또는 붕괴)을 통해 안정한 상태로 바뀌면서 방사선을 방출한다. 방사성 핵종이 붕괴할 때 방출되는 방사선의 종류와 수도 핵종마다 고유하게 정해져 있다. 예를 들면 `3H는 붕괴할 때마다 하나의 약한 베타 입자를 방출하며, 137Cs은 감마선을 0.85개 방출하는 외에 베타 입자와 X선도 방출한다.
방사성 물질이란 방사성 핵종을 기준 농도 이상 함유하고 있는 물질을 말한다. 우리 몸을 포함하여 자연계에 있는 모든 물질에는 천연 방사성 핵종이 미량 포함되어 있다. 따라서 기준치를 정하지 않으면 모든 물질이 방사성 물질이 되기 때문에 기준 농도를 둔다. 방사선을 내는 원천이 방사선원(源)이다. 방사선원은 방사성 물질과 방사선 발생장치로 대별된다. 방사성 물질은 내부의 방사성 핵종이 스스로 방사선을 내는 경우이며, 방사선 발생장치는 X선 장치처럼 인공적으로 방사선을 내도록 만든 장치이다. 병원에서 암치료에 사용하는 가속기도 방사선 발생장치이다.
방사능과 반감기
방사능(radioactivity)이란 ‘방사선을 내는 능력’이라는 의미로 곧 방사성 물질의 양을 나타낸다. 통상 물질의 양은 무게나 체적으로 나타내지만 그것만으로는 그 물질이 내는 방사선의 강도를 알기 어렵다. 이 때문에 1초와 같은 단위시간당 주어진 물질에서 일어나는 붕괴 수로 방사능을 나타낸다.
냄비에 1000알의 팝콘이 들어 있고 한 알의 팝콘이 1초당 튈 확률이 0.01로 일정하다고 가정하자. 그러면 맨 처음 1초에 튀는 팝콘 수는 1000×0.01=10개가 될 것이다. 어떤 물질 내에 방사성 핵(위의 예에서는 팝콘 알갱이 수)이 N개 있다고 하자. 각 핵이 단위시간당 붕괴할 확률(한 알이 1초당 튈 확률)을 λ라고 하면, N개의 핵이 붕괴할 수의 기대치인 방사능 A(1초에 튀는 팝콘 수)는 두 양의 곱, 즉 N λ가 된다. 이때의 확률, 즉 하나의 핵이 단위시간당 붕괴할 확률을 붕괴상수라고 하는데 이는 핵종 고유의 물리상수이다. 쉽게 변화시킬 수 있는 것이 아니다. 붕괴상수는 곧 그 핵종의 불안정한 정도를 나타내며 핵종마다 천차만별이다.
방사능의 기본 단위로 베크렐(becquerel ·Bq)을 사용하는데 1Bq은 매초 하나의 변화가 있음을 말한다. 전통적으로 방사능 단위로는 라듐을 발견한 퀴리부인의 이름을 딴 퀴리(curie·Ci)를 사용했다. 1Ci란 천연 방사성 물질인 라듐 1g에서 1초 동안 붕괴하는 수로 1Ci=3.7×1010(370억)Bq의 관계가 있다.
대개 Bq은 매우 작은 방사능 단위이고, Ci는 큰 단위이다. 따라서 실용량을 나타낼 때에는 각 단위에 k(1000), M(100만), G(10억) 또는 m(1/1000), μ(1/100만)과 같은 접두기호를 붙여 사용한다. 1MBq = 106Bq이다.
주어진 방사성 물질의 방사능은 일정한 것이 아니라 시간 경과에 따라 감소한다. 팝콘의 예에서 시간이 지나면 튀지 않고 남아 있는 팝콘 알갱이는 점점 줄어들어 어느 시점에는 절반인 500알이 된다. 이렇게 되면 1초당 튀는 수(방사능)는 500×0.01=5알이 된다. 이러한 방사능의 시간변화를 수식으로 쓰면 A = Aoe-λt 다. 여기서 Ao는 초기 방사능이며 A는 시간 t가 경과한 후 남은 방사능으로 e의 값은 약 2.72이다. 이 식을 지수 감소식이라 하는데 도표로 그리면 ‘그림 2’와 같은 곡선이 된다. 그림에서 보듯이 방사능은 시간이 지나면 점차 0에 가까워진다.
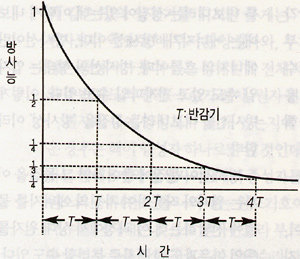
[그림 2] 시간 경과에 따른 방사능의 감소. 반감기 T가 경과함에 따라 방사능은 반으로 줄어든다.
핵분열과 핵분열생성물
반감기는 붕괴상수의 역수에 0.693을 곱한 것과 같다. 붕괴상수가 핵종마다 고유하므로 반감기도 고유하며 핵종에 따라 다 다르다. 예를 들어 우라늄(238U)의 반감기는 45억년인 데 반해, 암 진단에 사용되는 핵종인 18F의 반감기는 110분이다. 그래서 우라늄은 지구가 생성될 때부터 존재하던 것이 아직 땅속에 남아 있지만 환자에게 투여한 18F는 투여 후 며칠만 지나면 없어진다.
우라늄(235U)이나 플루토늄(239Pu)과 같은 핵분열성 핵종이 중성자를 흡수하면 그 원자핵이 깨지는 핵분열 반응이 일어나 핵이 쪼개지면서 에너지를 방출한다. 이 핵분열 에너지가 원자로의 에너지원이며 핵무기의 에너지원이 된다. 쪼개진 핵의 파편을 핵분열생성물이라 하는데 대체로 방사성핵이다. 이렇게 생성되는 방사성 핵종은 약 800종에 달하며 90Sr, 85Kr, 131I, 137Cs 등이 있다.
핵무기나 원자로에서 대량의 에너지를 얻기 위해서는 극히 많은 수의 핵분열이 필요하고 따라서 매우 많은 핵분열생성물이 발생하므로 핵폭발 낙진이나 원자로 핵연료에는 대량의 방사능이 들어 있다. 체르노빌 사고처럼 가동 중인 원자로에서 핵연료가 녹는 중대사고가 발생하면 수많은 종류의 방사성 핵종으로 구성된 대량의 방사능이 원자로 시설 외부로 방출될 수 있다.
대부분의 핵분열생성물 핵종의 반감기는 매우 짧기 때문에 시간이 지나면 방사능이 빠르게 감소한다. 따라서 핵폭발 지역에서 약 3일간 낙진대피호에 대피하면 낙진에 의한 치명적인 피해는 피할 수 있다. 마찬가지로 원전 중대사고에서도 결정적 피해를 당할 위험이 있는 기간은 사고 초기의 며칠이다. 그러나 일부 핵종은 반감기가 수십년이므로(90Sr 및 137Cs의 반감기는 약 30년) 꽤 오랫동안 방사능이 잔류한다. 그래서 1960년대에 집중적으로 실시된 대기권 핵실험으로 인한 방사능이 극히 미량이지만 아직도 낙진으로 떨어지고 있다.
사용후핵연료와 방사성폐기물
핵분열에 들어간 핵연료나 원자로 내 구조물처럼 많은 중성자에 노출되는 물질의 원자핵들은 중성자를 흡수하여 방사성 핵종으로 변환되기도 한다. 이렇게 생성된 방사성 핵종이 방사화 생성물이다. 철재와 같은 구조물이 방사화하면 그 내부에는 56Fe, 58Co(코발트), 60Co와 같은 방사화 생성물이 생긴다. 핵연료의 주성분인 238U이 방사화하면 239Pu, 241Am(아메리슘), 244Cm(큐리움)과 같이 우라늄보다 원자번호가 큰 인공 방사성핵종들이 생성되는데, 이 핵종을 초우라늄 원소라 부른다. 초우라늄 원소는 모두 방사성 핵종이다. 초우라늄 원소의 일부는 반감기가 매우 긴데 예를 들면 241Am의 반감기는 2만4000년이다.
원자로에서 3년 이상 태운 다음 꺼낸 사용후핵연료 안에는 대단히 많은 양의 핵분열생성물이 존재하므로 처분하거나 다른 장소로 이동하기 어렵다. 그래서 각 원전에서는 사용후핵연료를 냉각 저장하는 저장조를 두어 6년 이상 저장하고 있다. 이 기간이 지나면 반감기가 1년 미만인 대부분의 핵종은 붕괴하여 방사능이 크게 줄어든다.
그러나 핵종-핵분열생성물로 반감기가 약 30년인 90Sr과 137Cs, 타지 않고 남아 있는 우라늄, 그리고 초우라늄 원소인 239Pu, 241Am의 방사능은 상당히 높기 때문에, 재활용하지 않고 처분한다면 사용후핵연료는 고준위 방사성폐기물이 된다. 사용후핵연료를 재처리한다면 우라늄과 풀루토늄을 걸러낸 나머지 물질들이 고준위 방사성폐기물이 된다.
원전 운영과정에서 방사성 핵종에 오염된 물을 거른 필터나 작업자가 사용한 장갑, 작업복 등 오염된 잡다한 물건, 그리고 병원과 산업체, 대학 등에서 방사성 물질을 이용하는 과정에서 발생한 오염된 폐기물은 대개 반감기가 짧은 핵종을 미량 함유하고 있으므로 저준위 방사성폐기물로 분류한다.
경주 지역에 건설을 추진하는 폐기물처분장은 저준위 방사성폐기물을 처분하기 위한 것이다. 우리나라는 사용후핵연료의 재활용 여부를 아직 결정하지 않았으며 고준위 방사성폐기물 처분에 관한 기반 연구만 수행하고 있다.
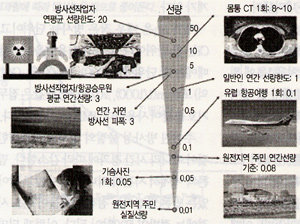
[그림 3] 방사선 피폭 준위 (단위: mSv).
사람이 쐰 방사선량은 시버트(Sv) 단위로 표시한다. 시버트는 많은 방사선량이므로 흔히 사용되는 방사선량 단위는 1000분의 1인 밀리시버트이다. 방사선원으로부터 방출된 방사선을 쐬는 것은 전구(방사선원)로부터 나온 빛(방사선)에 필름(피폭체)이 노출되는 것과 같다.
필름이 얼마나 짙게 감광되는가는 필름의 방사선 노출량에 비례하는데 노출량은 전구의 밝기, 전구와 필름과의 거리, 노출시간의 세 가지 요소가 주어져야 결정된다. 마찬가지로 방사선량을 결정하는 요소도 방사선원의 강도(방사능), 선원(線源)과 피폭자 사이의 거리, 그리고 피폭시간이다.
우리 국민은 거주지역에 따라 연간 1.5∼4밀리시버트의 자연방사선을 쐬며 평균적으로는 3밀리시버트를 쐬고 있다. 의료방사선에 의해서도 많은 선량을 쐬는데 X선 가슴사진은 촬영당 0.05밀리시버트 정도, CT 촬영은 1회에 5밀리시버트 이상을 쐬게 된다.‘그림 3 참조’
방사성 오염과 환경방출
오염이란 어떤 이물질이 바라지 않은 곳에 혼입되는 것을 말한다. 방사성 오염은 방사성 핵종에 의한 오염으로 엄밀하게는 방사성 오염이란 표현이 옳으나 통상 방사능 오염이 같은 의미로 통용되고 있다. 방사성 오염은 물질이 혼입되는 것임에 반해 방사선 피폭은 물질이 아닌 방사선이 물체에 에너지를 전달하는 것이다. 따라서 방사선에 피폭된 사람이나 방사선 처리를 거친 조사(照射)식품은 방사능에 오염되는 것은 아니다.
원자로 내부를 경유하는 1차 냉각수(냉각재)는 핵연료에서 작은 비율로 누설되는 핵분열 생성물(주로 삼중수소, 불활성 기체인 Kr, Xe, 고온에서 휘발성이 큰 I, Cs 등)과 방사화 생성물(주로 Mn 및 Co 동위원소)에 의해 오염된다.
1차냉각수(냉각재) 중 불활성 기체는 추출하여 지연붕괴시켜 방사능이 낮아지면 대기 중으로 방출한다. 입자 방사성 물질은 필터로 걸러 농도를 일정 수준 이하로 유지한다. 이때 사용한 필터는 고체 방사성폐기물로 관리된다. 오염된 냉각수가 누설되면 액체 방사성폐기물이 발생하는데 액체 방사성폐기물은 필터, 이온교환수지, 증발기 등을 통해 방사능을 걸러 농도를 낮춘 후 바다로 방출한다.
|
정상 운영되는 원전에서 위와 같은 과정을 거쳐 환경으로 방출되는 방사능에 의해 지역 주민이 쐴 수 있는 방사선량은 연간 0.1밀리시버트 미만이다. 이 선량은 1회 유럽 여행을 하기 위해 비행기를 탔을 때 쐬는 우주 방사선량과 비슷하다. 정상 운영되는 원자력시설 주변 주민이 원자력시설로 인해 쐬는 방사선량은 무의미할 정도로 적다.























![[지상중계] 제12회 나지포럼, “북미 정상회담 성과내기 어려워”](https://dimg.donga.com/a/380/211/95/1/ugc/CDB/SHINDONGA/Article/69/43/48/32/69434832107aa0a0a0a.jpg)
